새로운 건선치료제, IL-23 inhibitor, 트렘피어(구셀쿠맙)·Tremfya(Guselkumab) 급여인정
첨부파일
-
- 첨부파일: Tremfya.jpg (53.7K)70
짧은주소
본문
새로운 건선치료제, IL-23 inhibitor, 트렘피어(구셀쿠맙)·Tremfya(Guselkumab) 급여인정
한국얀센의 트렘피어(성분명 구셀쿠맙)가 만성염증질환인 건선에서 유용한 치료옵션으로 자리매김할 것으로 전망이 나왔다.
트렘피어는 건선 발병의 주요 원인인 인터루킨-23(IL-23)의 하위 단백질 ‘p19와’ 선택적으로 결합, IL-23의 신호전달 경로를 차단 또는 저해하는 기전을 가진 첫 생물학적 제제다.
지난 4월 식품의약품안전처로부터 허가를 받은데 이어 이달부터 급여가 적용돼 출시됐다.
이로서, '스텔라라(우스테키누맙)'에 이어, '코센틱스(세쿠키누맙)', '탈츠(익세키주맙)', '트렘피어(구셀쿠맙)'이 건선에 지난 9월 1일부터 급여가 됐다. 이로서 모든 IL inhibitor가 급여화 된 것이다.
생물학적제제는 피부 또는 근육에 주사/점적 하는 방식으로, 다른 치료법으로 치료가 어려운 경우나 중등도 이상의 건선 환자에 효과적이다.
국내에 출시돼 건선에 적응증을 가진 생물학적 제제는 종양괴사인자-알파 억제인 'TNF 억제제'가 대표적이다. 에타너셉트(엔브렐), 인플릭시맙(레미케이드), 아달리무맙(휴미라) 등이 그 예.
그런데 TNF 억제제는 모든 환자가 효과를 볼 수 있는 것은 아니며, 효과를 보더라도 계속해서 지속되지 않을 수 있다.
치료 초기 10~40%의 환자는 반응이 없으며, 이차 반응 소실 비율은 치료 1년째 20~40%에 달한다. 또 다른 연구에 의하면 크론병 환자가 관해를 1년, 2년, 5년, 10년간 유지하는 비율은 각각 80%, 60%, 33%, 24%에 불과하다.
이에 후발주자로 출시된 IL inhibitor가 빠르게 급여에 성공한 것은 `높은 효과` 덕분이라고 분석된다. 실제로 인터루킨 억제제는 건선 개선의 척도인 PASI 90에 도달한 환자군이 기존 치료제보다 많다는 점에서 의사들로 하여금 긍정적인 평가를 받고 있다.
특히 트렘피어는 휴미라와, 탈츠는 엔브렐과의 직접 비교임상을 통해 우월성을 입증했다.
물론 건선은 자가면역질환이기에 `장기적 효과`에 대한 입증도 필요하다. 이는 코센틱스가 건선 치료 5년차에 높은 피부 증상 완화효과를 입증했다는 데이터를 보유하고 있다.
트렘피어는 3상 임상연구(중등도에서 중증의 2,000명 이상 건선 환자, 다국가 임상)에서 3회 투여 후인 16주차에 80% 이상 환자에서 증상이 소실되었거나 대부분 소실된 것이 확인됐다.
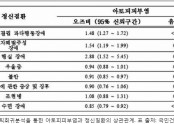
특히 ‘VOYAGE 1’ 연구 결과, 24주차에 피부 병변이 완전히 깨끗해지는 PASI 100 반응률 및 IGA 점수 0점에 도달한 환자 비율이 각각 44.4%, 52.6%로 아달리무맙(제품명 휴미라) 투여군(24.9%, 29.3%)보다 높았다.
16주차에서도 트렘피어 투여군은 3회 투여 후 90% 의 피부 병변이 개선되는 것을 의미하는 PASI 90에 도달한 환자 비율이 73.3%, 아달리무맙 투여군은 49.7%였다.
트렘피어는 증상 개선이 어려운 두피 및 손발 건선에서도 아달리무맙 투여군 대비 유의미한 개선 효과를 보였다는 게 회사의 설명이다.
회사에 따르면 24주 및 48주차에 증상이 완전히 또는 거의 완전히 소실된 환자비율이 두피 건선에서 트렘피어 투여군은 각각 84.5%, 78.3%, 아달리무맙 투여군은 69.2%, 60.5%였다.
손발 건선에선 트렘피어 투여군ㅣ 78.9%, 75.6%, 아달리무맙이 56.8%, 62.1%인 것으로 나타났다.
트렘피어는 투여 첫 시점 0주와 4주차에 100mg을 투여하고, 이후에는 매 8주 간격으로 100mg을 피하 주사한다.
대상은 6개월 이상 지속되는 만 18세 이상 만성 중증 판상 건선 환자 가운데 ▲판상 건선이 전체 피부 면적의 10% 이상 ▲PASI(Psoriasis Area and Severity Index) 10 이상이면서 ▲메토트렉세이트(Methotrexate; MTX) 또는 사이클로스포린(Cyclosporine)을 3개월 이상 투여했음에도 반응이 없거나 부작용 등으로 치료를 지속할 수 없는 경우 혹은 ▲피부광화학요법(PUVA) 또는 중파장자외선(UVB)으로 3개월 이상 치료하였음에도 반응이 없거나 부작용 등으로 치료를 지속할 수 없는 경우다.
중증 보통 건선은 지난해 6월부터 산정특례 대상 질환으로 지정돼 대상자 요건을 충족하는 경우 환자는 치료비의 10%만 부담하면 된다.
제니 정 한국얀센 대표이사는 “얀센은 레미케이드, 스텔라라에 이어 IL-23의 경로를 선택적으로 차단하는 최초 생물학적제제인 트렘피어까지 자가면역질환의 주요 원인에 작용하는 혁신적인 치료제를 개발했다”며 “앞으로도 자가면역 질환인 건선 영역에서 보다 나은 치료 환경을 제공할 수 있도록 지속적으로 노력하겠다”고 전했다.
스텔라라는 지난 2011년 광선요법 또는 전신치료요법을 필요로 하는 중등도 및 중증의 성인 판상 건선 환자의 치료에 허가를 받은바 있다. 지난해부턴 만 12세 이상의 소아 판상 건선 환자도 사용할 수 있도록 적응증이 확대됐다.
레미케이드는 2008년 중등도-중증의 성인 판상 건선 환자의 치료제로 허가를 받았다.
































댓글목록
등록된 댓글이 없습니다.